Variables de proceso.
Introducción a la ingeniería química/de proceso.
Temperatura.
Temperatura.

Temperatura.
Ley cero de la termodinámica
Si dos objetos se encuentran en equilibrio térmico con un tercero, deben estar en equilibrio térmico entre sí.
Si \(T_A=T_C\) y \(T_B=T_C\), entonces \(T_A=T_B\).
Temperatura: escalas relativas.
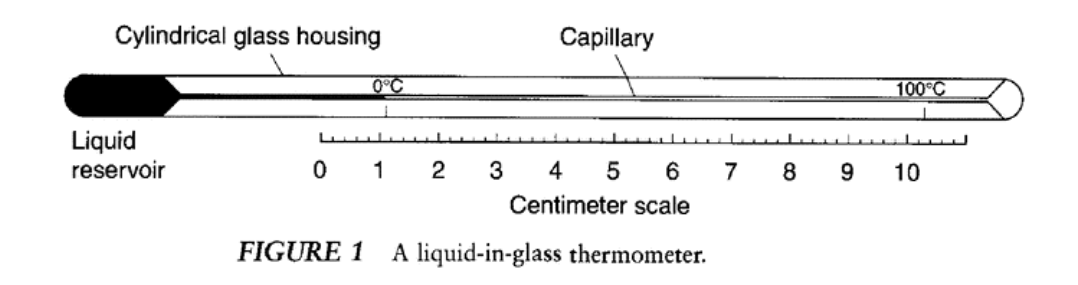
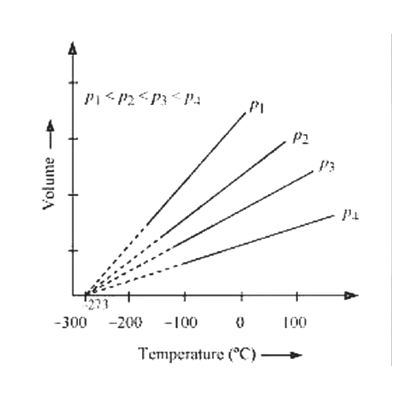
Temperatura: ley de Charles.
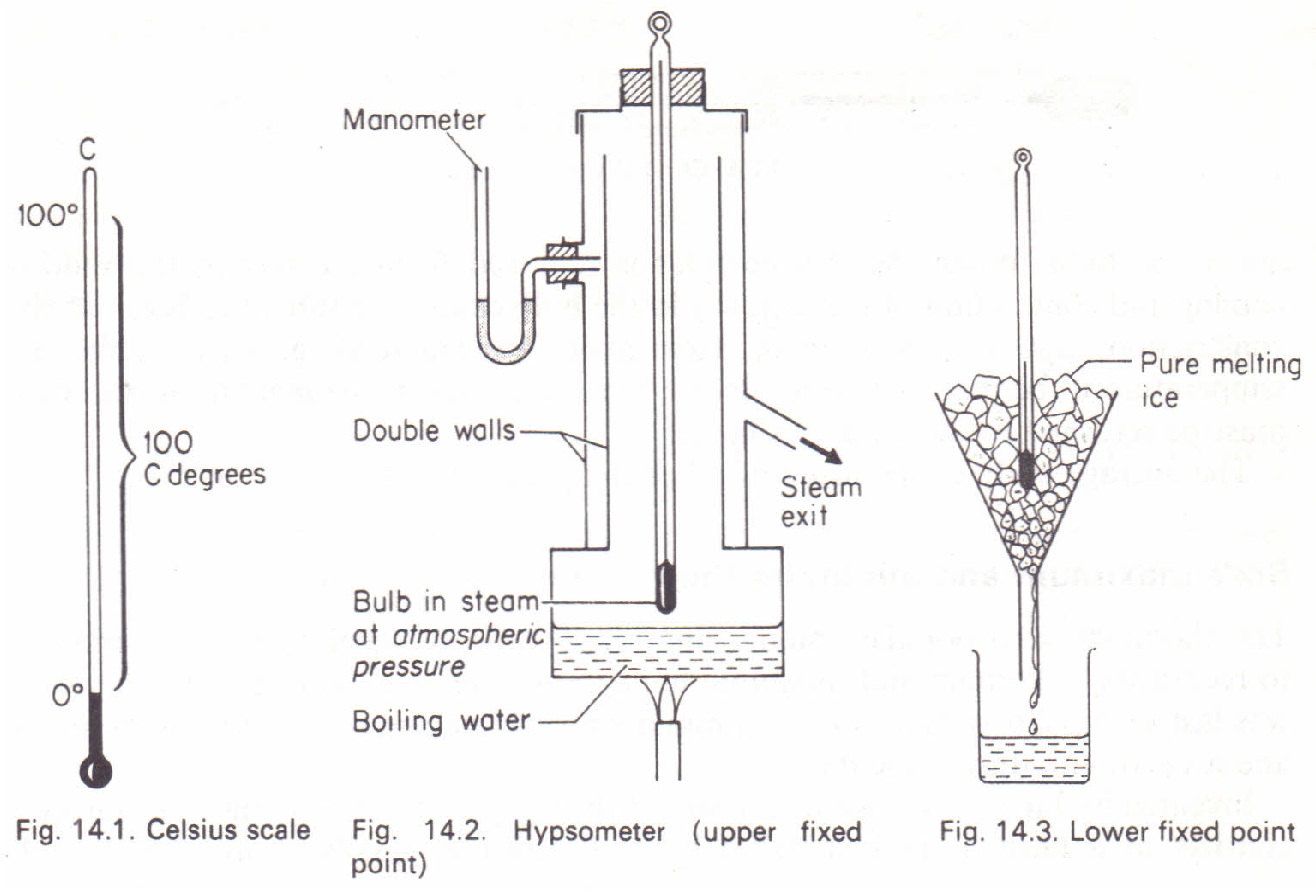
Temperatura: punto triple del agua.
Temperatura: escala del gas ideal.
\[ \frac{T_1}{T_2}=\frac{V_1}{V_2} \\ \frac{T_1}{T_2}=\frac{P_1}{P_2} \]
Temperatura: significado físico.
\[ PV=\frac{2}{3}N E_{tr} \]
Por lo tanto: \[ E_{tr}=\frac{3n}{2N} RT \]
Temperatura: conversiones.
\[ T(K)=T(ºC)+273.15 \\ T(ºF)=\frac{9}{5}T(ºC)+32 \\ T(ºR)=T(ºF)+459.67 \]
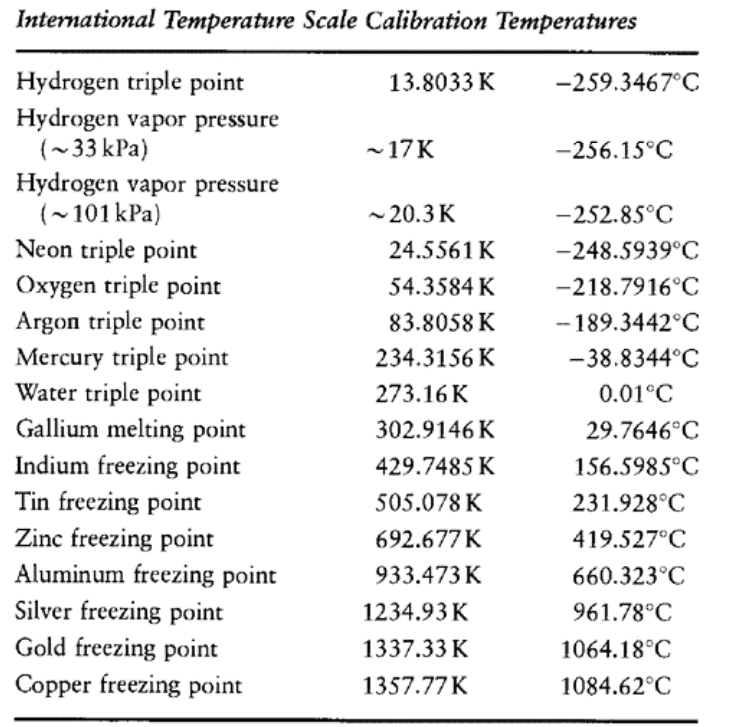
Temperatura: ITS-90.
Temperatura: otros instrumentos.
- Termómetros de resistencia.
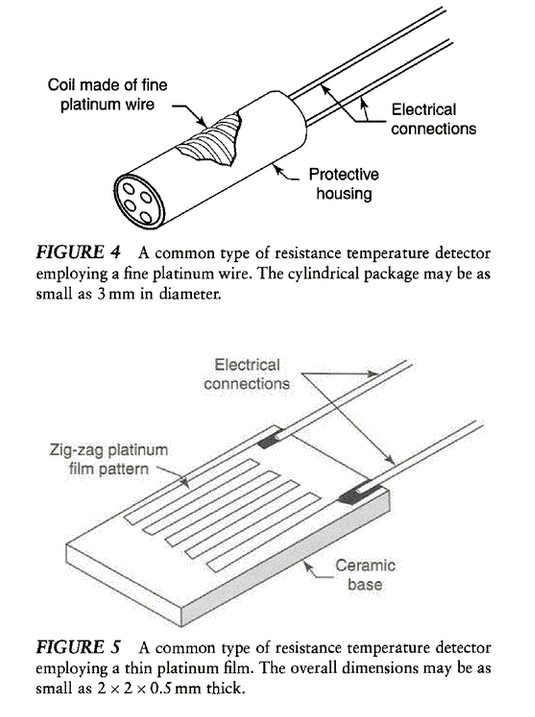

Temperatura: otros instrumentos.
Termistor 
Termocuplas 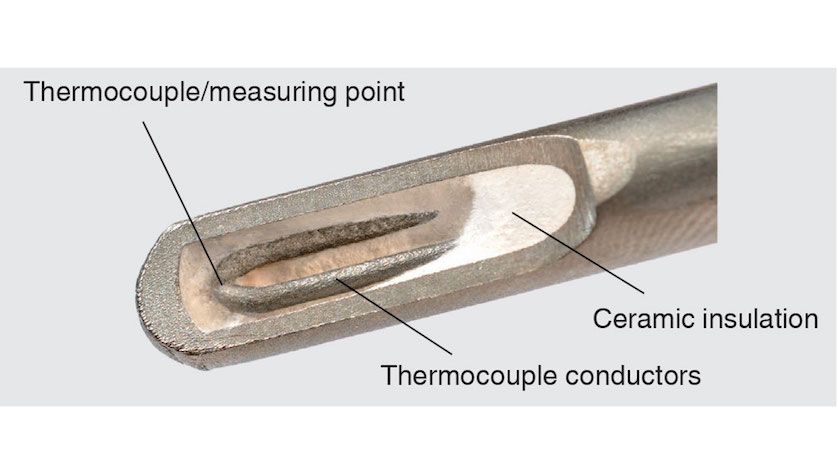
Temperatura: medidores infrarojos.
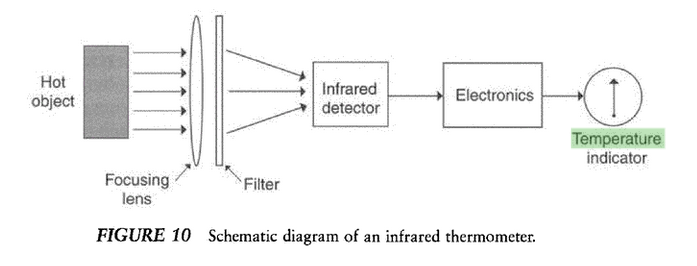

Presión.
Presión: significado físico.
\[ P=\frac{F}{A} \]
Presión: unidades.
| \(101 325 Pa \equiv 14.7 PSI \equiv 1 atm \equiv 760 mm Hg \equiv 407.189 in H_2 O\) |
Intermedio: densidad.
Densidad y conceptos asociados.
- Densidad.
- Gravedad específica.
- Peso específico.
- Volumen específico y volumen molar.
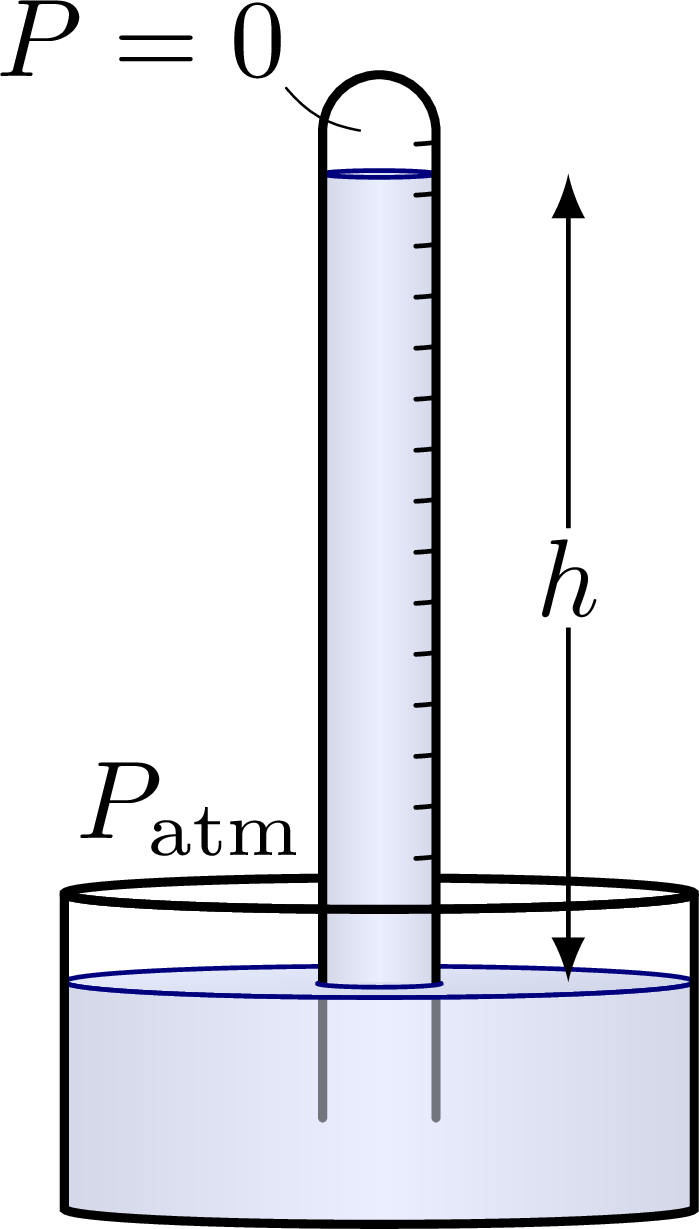
Presión: medición.
Presión absoluta: medida contra un vacío total.
Presión manométrica: medida contra una presión conocida.
Presión atmosférica: presión que ejerce el aire de la atmósfera.
\[ P_{abs}=P_g + P_{atm} \]
Presión: medición.
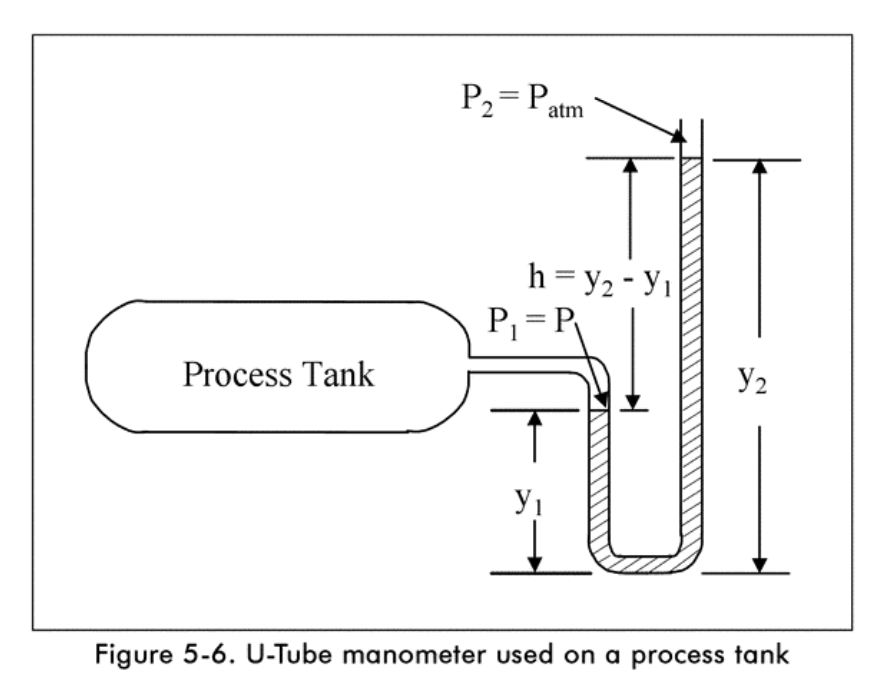
Presión: medición.

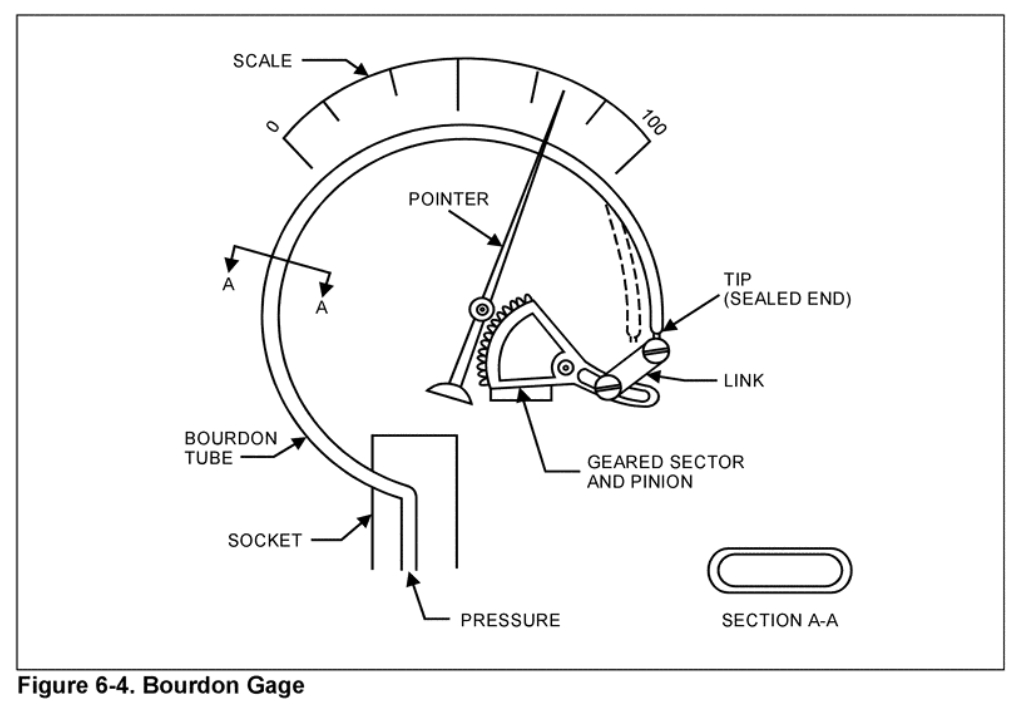
Presión: medición.

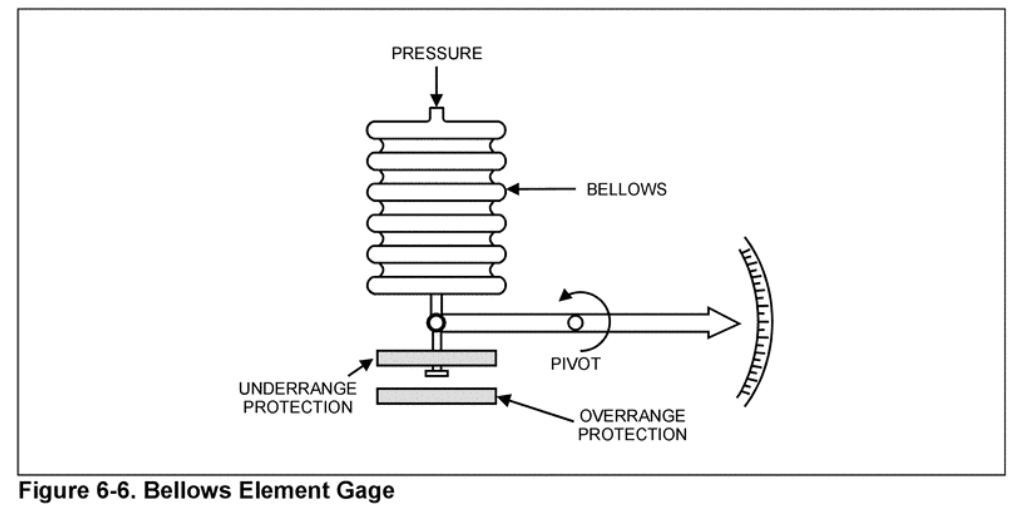
Presión: medición.

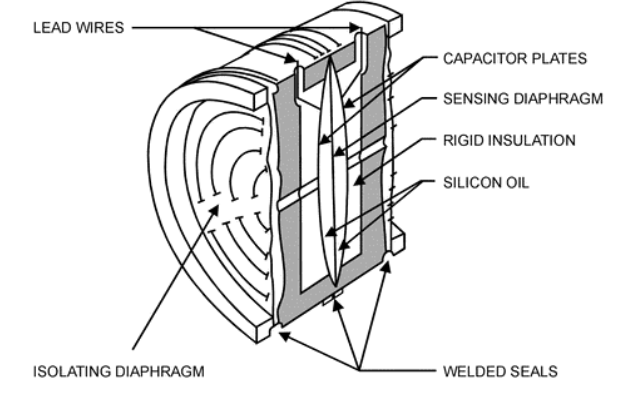
Flujos.
Flujo: tipos.
\[ \dot{Q}=v A\\ \dot{M}=\dot{Q} \rho \\ \dot{n}=\frac{\dot{M}}{w} \]
Flujo: medición.
Medidores diferenciales: relacionan el flujo con la caída de presión en una variación provocada en el fllujo. \[ Q=k\sqrt{\Delta P} \]
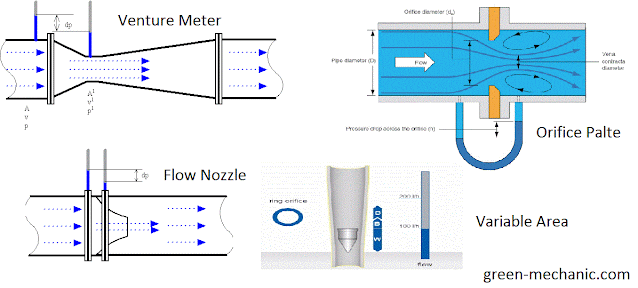
Flujo: medición.
Rotámetros: instrumentos que equilibran el peso de un objeto, la fuerza de flotación y la resistencia del fluido en un conducto de área variable.

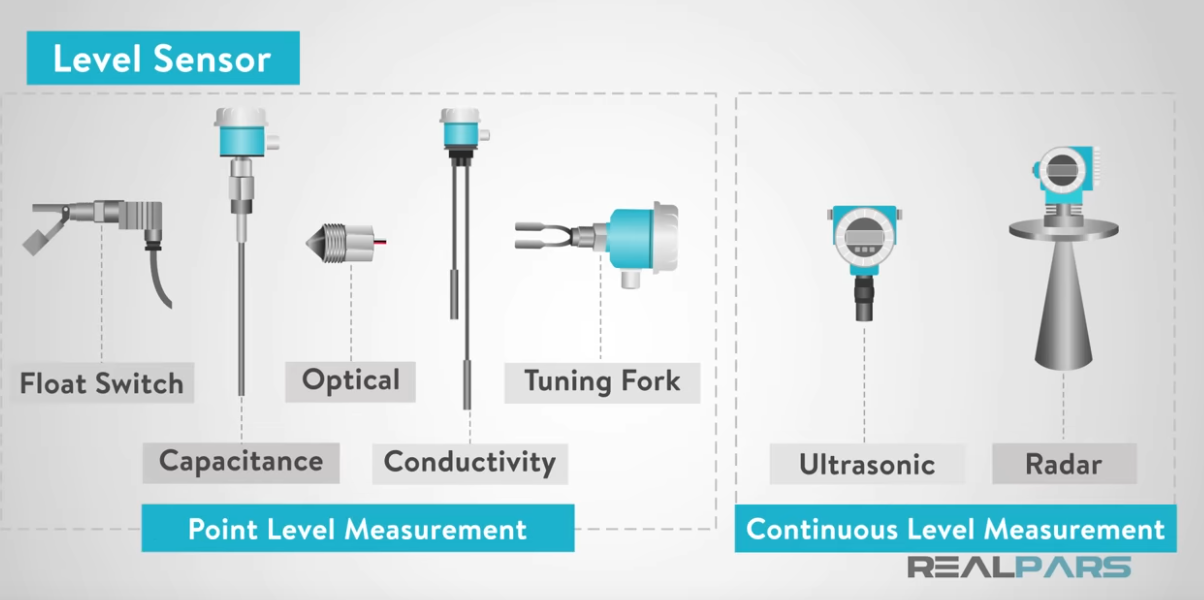
Nivel.
Nivel: medición.
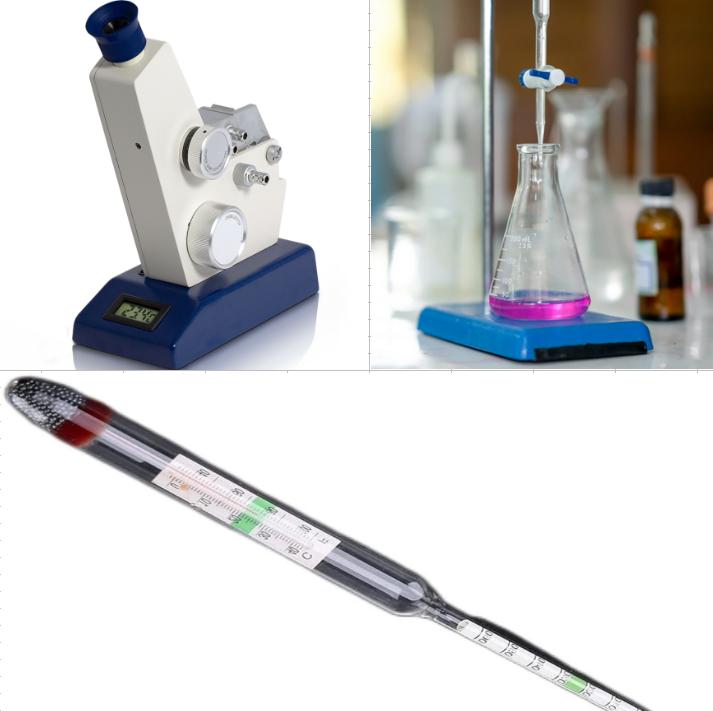
Concentración.
Concentración: medición.
Concentración: medición.
Concentración: medición.
- Refractometría.
- Titulación.
- pH.
- Densidad.
- Etc
Concentración: el mol.
\(1 mol \equiv 6.022 \times 10^{23}\) unidades \(\equiv\) masa atómica expresada en gramos.
Cantidad de sustancia que contiene tantas unidades como átomos en 12 gramos de carbono-12.
\[ n=\frac{m}{w} \]
Concentración: el mol - ejercicios.
¿A cuántos gramos equivalen 15 moles de:
- Helio.
- Agua.
Se descomponen 13 libras de carbonato de calcio en óxido de calcio y dióxido de carbono. ¿Cuántas libras de dióxido de carbono se producen?
Concentración: expresiones de concentración.
\[ \% \frac{m}{m}=\frac{m_{sto}}{m_{sln}}\times 100 \\ \% \frac{m}{v}=\frac{m_{sto}}{V_{sln}}\times 100 \\ \% \frac{v}{m}=\frac{V_{sto}}{m_{sln}}\times 100 \\ \% \frac{v}{v}=\frac{V_{sto}}{V_{sln}}\times 100 \]
Concentración: expresiones de concentración.
\[ ppm=\frac{mg_{sto}}{kg_{sln}} \\ ppm=\frac{mg_{sto}}{L_{sln}} \\ ppb=\frac{\mu g_{sto}}{kg_{sln}} \\ ppb=\frac{\mu g_{sto}}{L_{sln}} \]
Concentración: expresiones de concentración.
\[ M=\frac{n_{sto}}{L_{sln}} \\ N=\frac{eq_{sto}}{L_{sln}} \]
Concentración: expresiones de concentración.
\[ x_i=\frac{n_i}{n_{sln}} \]
